La configuración electrónica es la manera en la cual los electrones se estructuran en un átomo, molécula o en otra estructura física, de acuerdo con el modelo de capas electrónico, en el cual la función de onda del sistema se expresa como un producto de orbitales antisimetrizado. Cualquier conjunto de electrones en un mismo estado cuántico deben cumplir el principio de exclusión de Pauli al ser partículas idénticas. Por ser fermiones (partículas de espín semientero) el principio de exclusión de Pauli nos dice que la función de onda total (conjunto de electrones) debe ser antisimétrica. Por lo tanto, en el momento en que un estado cuántico es ocupado por un electrón, el siguiente electrón debe ocupar un estado cuántico diferente.
En los átomos, los estados estacionarios de la función de onda de un electrón en una aproximación no relativista (los estados que son función propia de la ecuación de Schrödinger 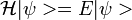 en donde
en donde 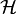 es el hamiltoniano monoelectrónico correspondiente; para el caso general hay que recurrir a la ecuación de Dirac de la mecánica cuántica de campos) se denominan orbitales atómicos, por analogía con la imagen clásica de los electrones orbitando alrededor del núcleo. Estos estados, en su expresión más básica, se pueden describir mediante cuatro números cuánticos: n, l, m y ms, y, en resumen, el principio de exclusion de Pauli implica que no puede haber dos electrones en un mismo átomo con los cuatro valores de los números cuánticos iguales.
es el hamiltoniano monoelectrónico correspondiente; para el caso general hay que recurrir a la ecuación de Dirac de la mecánica cuántica de campos) se denominan orbitales atómicos, por analogía con la imagen clásica de los electrones orbitando alrededor del núcleo. Estos estados, en su expresión más básica, se pueden describir mediante cuatro números cuánticos: n, l, m y ms, y, en resumen, el principio de exclusion de Pauli implica que no puede haber dos electrones en un mismo átomo con los cuatro valores de los números cuánticos iguales.
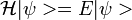 en donde
en donde 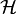 es el hamiltoniano monoelectrónico correspondiente; para el caso general hay que recurrir a la ecuación de Dirac de la mecánica cuántica de campos) se denominan orbitales atómicos, por analogía con la imagen clásica de los electrones orbitando alrededor del núcleo. Estos estados, en su expresión más básica, se pueden describir mediante cuatro números cuánticos: n, l, m y ms, y, en resumen, el principio de exclusion de Pauli implica que no puede haber dos electrones en un mismo átomo con los cuatro valores de los números cuánticos iguales.
es el hamiltoniano monoelectrónico correspondiente; para el caso general hay que recurrir a la ecuación de Dirac de la mecánica cuántica de campos) se denominan orbitales atómicos, por analogía con la imagen clásica de los electrones orbitando alrededor del núcleo. Estos estados, en su expresión más básica, se pueden describir mediante cuatro números cuánticos: n, l, m y ms, y, en resumen, el principio de exclusion de Pauli implica que no puede haber dos electrones en un mismo átomo con los cuatro valores de los números cuánticos iguales.De acuerdo con este modelo, los electrones pueden pasar de un nivel de energía orbital a otro ya sea emitiendo o absorbiendo un cuanto de energía, en forma de fotón. Debido al principio de exclusión de Pauli, no más de dos electrones pueden ocupar el mismo orbital y, por tanto, la transición se produce a un orbital en el cual hay una vacante.

No hay comentarios:
Publicar un comentario